Date: September 2018
Eierstockkrebs gilt als relativ seltenes, gynäkologisches Malignom, weist jedoch aufgrund der unspezifischen Symptome, die im Frühstadium der Erkrankung auftreten, eine der höchsten Sterblichkeitsraten auf. Dies führt dazu, dass bei den meisten Frauen eine Erkrankung im fortgeschrittenen Stadium diagnostiziert wird. Die Inzidenz von Eierstockkrebs in den Vereinigten Staaten beträgt etwa 22.000 Fälle pro Jahr und führt zu etwa 14.000 Todesfällen pro Jahr.
Obwohl bei Krebsbehandlungen und chirurgischen Ansätzen eine Reihe von Fortschritten erzielt wurden, haben nur geringe Fortschritte bei der Therapie von Eierstockkrebs einen bedeutenden Einfluss auf diese Patientenpopulation. Während die anfänglichen Ansprechraten hoch sein können, erleiden mehr als 80 % der Patienten nach der Front-Line-Therapie einen Rückfall und mehr als 50 % dieser Frauen sterben innerhalb von 5 Jahren nach der Diagnose .
Eingeschränkte Second-Line-Optionen bei refraktären First-Line-Patientinnen tragen zusammen mit der Diagnose im Spätstadium zu schlechten Gesamtüberlebenszahlen bei und machen dies zu einem höchst ungedeckten medizinischen Bedarf, der ein aktiver Bereich der onkologischen Arzneimittelforschung war. Der jüngste Erfolg mit Immuntherapien bei anderen Krebsarten gibt den Patientinnen mit Eierstockkrebs Hoffnung. Laut einer der vielversprechendsten Datenveröffentlichungen korrelierte das Vorhandensein von Tumor-infiltrierenden Lymphozyten positiv mit einem verbesserten Gesamtüberleben von Patientinnen mit Ovarialkarzinom.[1]
ID8-Ovarialkarzinom-Mausmodell zur Verwendung als präklinisches syngenes Modell
At Labcorp we have established the ID8 murine ovarian carcinoma model as a preclinical syngeneic model that can be used to track and monitor disease progression and therapeutic outcomes. Unser Modell beruht auf der intraperitonealen Abgabe von Luciferase-exprimierenden ID8-Zellen, um Aspekte menschlicher Krankheiten nachzuahmen. Nach der In-vivo-Implantation zeigen die ID8-luc-Zellen eine 7- bis 8-tägige Tumorverdopplungszeit und ein mittleres Gesamtüberleben von etwa 40 bis 50 Tagen. Ein Verlust an Körpergewicht im Zeitverlauf wurde in diesem Modell nicht beobachtet. Eine Gewichtszunahme ist jedoch aufgrund der Anhäufung von Peritonealaszites im Zusammenhang mit einer Erkrankung im Spätstadium üblich. (Abbildungen 1A, B, C).
Abb. 1: In-vivo-Bewertung des ID8-luc-Modells in C67BL/6-Mäusen im Zeitverlauf
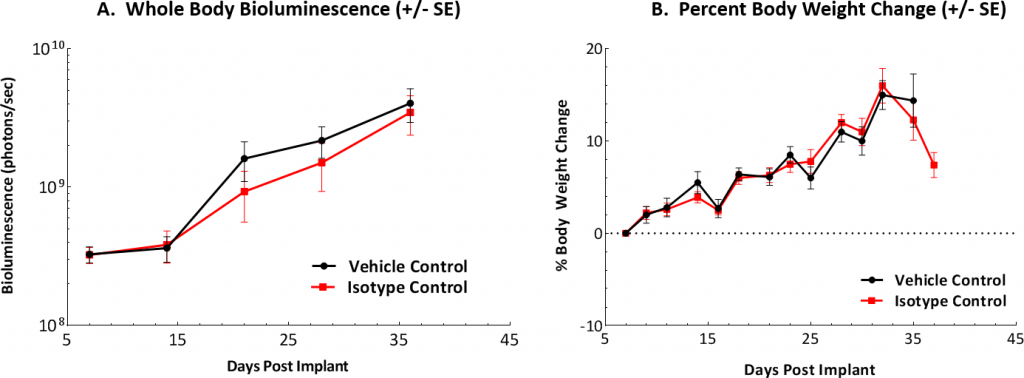
Abb. 1A: Grafische Darstellung der Tumorlast bei Kontrollmäusen nach IP-Implantation.
Abb. 1B: Das Körpergewicht wurde dreimal wöchentlich gemessen und die prozentuale Veränderung gegenüber dem Tag der Implantation (Tag 0) wird dargestellt.
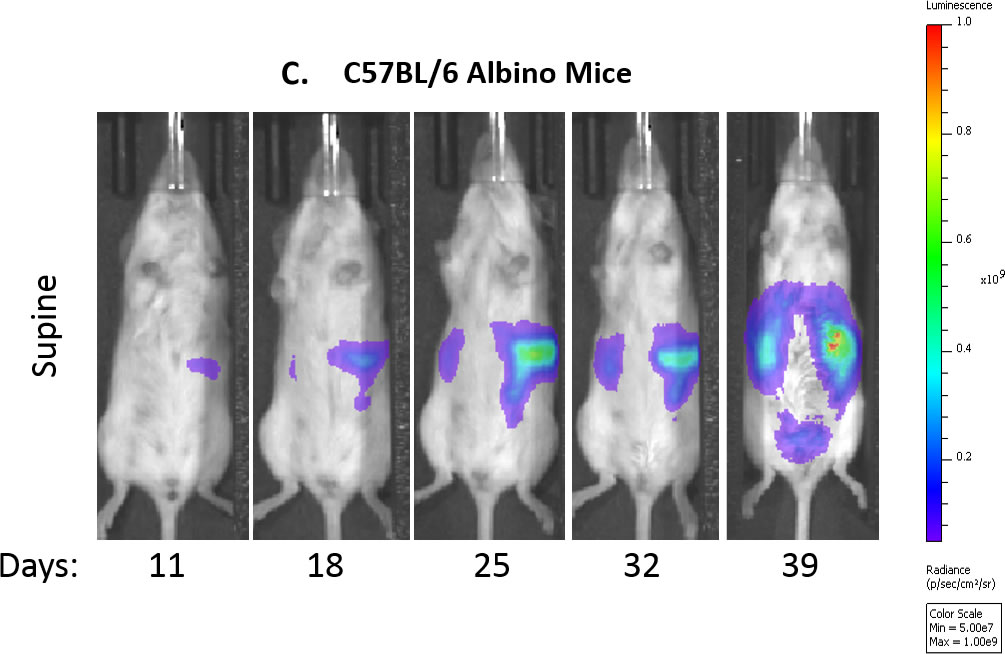
Abb. 1C: Repräsentative Biolumineszenzbilder der Kontrollmaus im Zeitverlauf.
Immunphänotyp-Bewertung der Aszitesflüssigkeit
Klinische Beobachtungen zeigen ein verlängertes Abdomen aufgrund der Ansammlung von Aszites in einem fortgeschritteneren Krankheitszustand. Bei der Autopsie werden feste Tumorknoten in der Bauchhöhle, einschließlich Bauchspeicheldrüse, Leber, Milz und Bauchdecke, beobachtet.
Das Verständnis des Immunzellprofils von syngenen Modellen ist ein wichtiger Aspekt bei der Modellauswahl. Daher haben wir den Immunphänotyp der Aszitesflüssigkeit ausgewertet (Abbildungen 2A, B, C) und einen hohen Prozentsatz an B-Zellen, granulozytischen myeloischen Suppressorzellen (G-MDSCs) und Tumor-assoziierte Makrophagenzellen (TAM) vom Typ M1 und M2 gefunden. Eine weitere Bewertung der beobachteten, festen Tumorknoten wird folgen.
Abb. 2: Immunphänotypisierung von Aszites aus ID8-luc-implantierten Mäusen
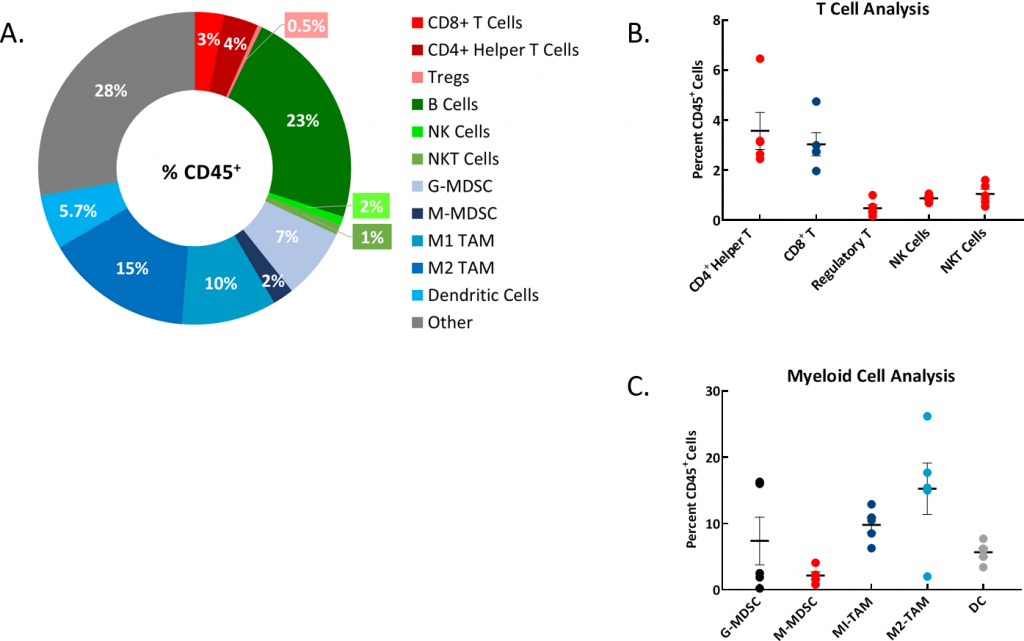
Abb. 2A: Ein repräsentatives Donut-Diagramm zeigt die Verteilung der Immunzellpopulationen als Prozent der gesamten CD45+-Population.
Abb. 2B: Analyse der T-Zellpopulationen.
Abb. 2C: Analyse der myeloiden Zellpopulationen. Studienlauf mit n=5 individuelle Aszites-Proben der Mäuse
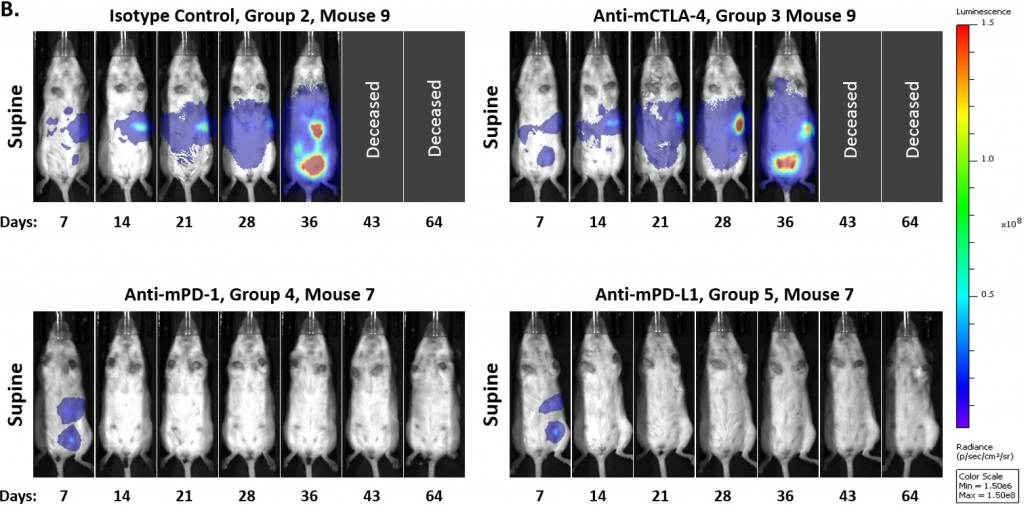
Um festzustellen, ob das Modell auf die Hemmung des Immun-Checkpoints ansprach, testeten wir Anti-mPD-1-, Anti-mPD-L1- und Anti-mCTLA-4-Antikörper 7 bzw. 14 Tage nach der Tumorzellimplantation. Wie bei vielen soliden syngenen Tumormodellen stellten wir fest, dass das Ansprechen auf diese Therapien je nach Zeitpunkt des Behandlungsbeginns unterschiedlich war. In den Abbildungen 3A und 3B zeigen wir, dass der Beginn der Behandlung mit Anti-mPD-1 oder Anti-mPD-L-1-Antikörpern 7 Tage nach der Tumorzellimplantation zu einer vollständigen Regression der Tumoren führte, so dass diese Staging-Zeit für eine Kombination von Wirkstoffen ungeeignet war. Im Gegensatz dazu schien das Modell gegenüber einer Anti-mCTLA-4-Behandlung refraktär zu sein. Darüber hinaus beobachteten wir, dass sich ein kleiner Prozentsatz der Kontrolltumoren spontan zurückbildete, als die Studie am Tag 7 begonnen wurde.
Abb. 3: Intraperitoneale ID8-luc: mittleres und individuelles Ganzkörper-BLI-Signal im Zeitverlauf
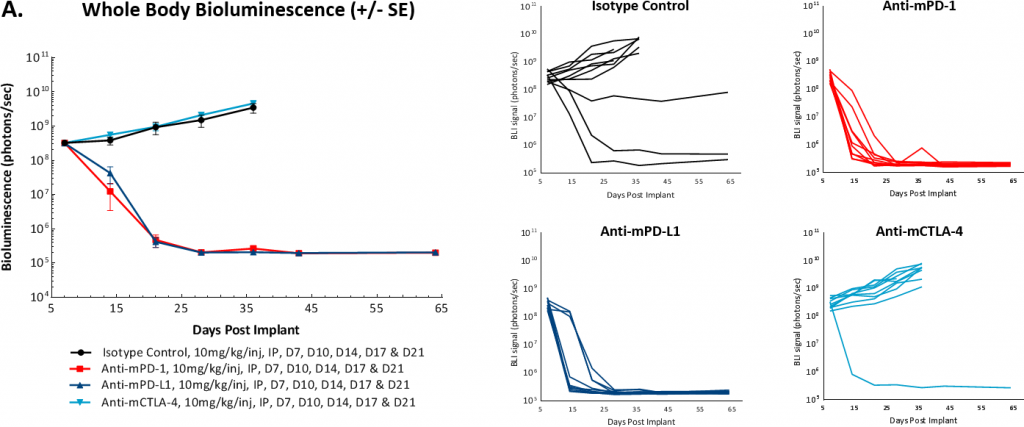
In einer Folgestudie verzögerten wir den Beginn der Behandlung auf 14 Tage nach der Tumorzellimplantation und sahen keine spontane Regression von Kontrolltumoren. Wir beobachteten auch eine Modulation der Gesamtansprechrate auf die Anti-mPD-1- oder Anti-mPD-L1-Therapien. Dennoch schien es, dass diese Antikörper eine „Alles oder Nichts“-Behandlungsreaktion hervorriefen. Darüber hinaus hatte die Reduzierung der Antikörperdosis von 10 mg/kg auf 5 mg/kg keinen wesentlichen Einfluss auf die Antitumoraktivität dieser Wirkstoffe (Abbildung 4). Künftige Arbeiten werden den weiteren verzögerten Beginn der Antikörperdosierung bewerten, um festzustellen, ob wir die Einzelwirkstoffaktivität dieser Checkpoint-Inhibitoren weiter reduzieren können.
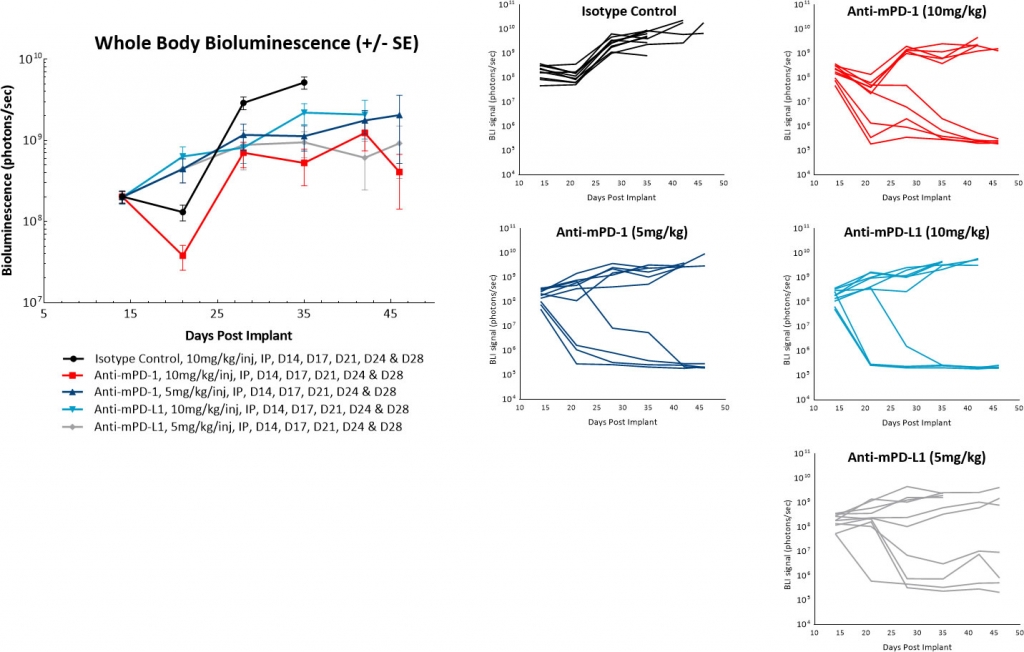
Tabelle 1: Lungenkrebszelllinien
Siehe unsere A549-Wachstumskurve:
A549: Humanes Lungenkarzinom
Labcorp has multiple lung cancer cell lines available for use (Table 1). Please contact us to run your next lung cancer study.
Abb. 4: Intraperitoneale ID8-luc: mittleres und individuelles Ganzkörper-BLI-Signal nach Behandlung mit Checkpoint-Inhibitor-Antikörpern
Verweise
Unterhalten wir uns
Kontakt